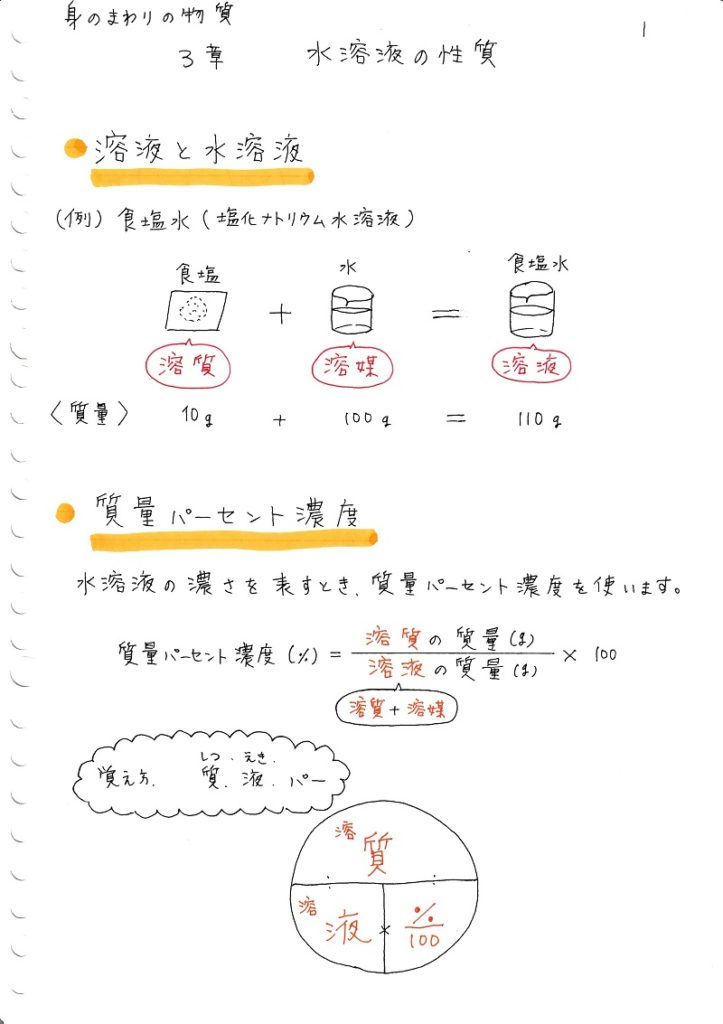
(1) 質量パーセント濃度 質量パーセント濃度は、溶液の質量にたいして溶質の質量がどれくらい含まれているかを表すもので、100gの溶液中に含まれる溶質の質量(g)を表します。 (2) (体積)モル濃度 濃度のはなし~高校生向け モル濃度と質量モル濃度について~ 21年2月1日 学習内容解説ブログサービスリニューアル・受験情報サイト開設のお知らせ 学習内容解説ブログをご利用下さりありがとうございます。 開設以来、多くの皆様にご利用いただい化学基礎・化学講座 濃硫酸から希硫酸を作る問題 解説編 別府市学習塾 進学予備校ウインロード 上野丘・舞鶴・鶴見丘受験、難関大学受験 別府で数学 物理 化学 英語 国語に強い塾。小学生・中学生は全教科個別演習指導|中学受験 高校受験 大学受験 医学部受験
モル濃度 質量パーセント濃度 質量モル濃度 濃度計算のコツも解説 受験メモ
質量パーセント濃度 問題 高校
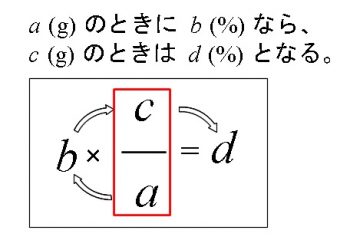
質量パーセント濃度 問題 高校-5% 19% Q3 モル濃度とは、どのような濃度か? 溶液の質量に対する溶質の質量をパーセントで表した濃度 溶液 1L の中に溶けている溶質の物質 高校化学では、 質量パーセント濃度・モル濃度・質量モル濃度 の3つの濃度を習います。 多くの高校生が濃度計算でつまづくのは、 これらの定義をきちんと覚えられていないからです。 まずは濃度の定義を覚えていくのが第一段階ですね。 濃度の定義



溶液の質量パーセント濃度の求め方と比重を利用した計算問題
1.質量パーセント濃度とは、どのような濃度か? 2.モル濃度とは、どのような濃度か? 3.質量パーセント濃度が分かっている溶液のモル濃度を求める手順はどうだったか? お疲れさまでした。 次回からは5章。いよいよ化学反応について考えていきます。現在高校一年生です。 問題集に次のような問題があったのですが、 回答の意味がわかりません。誰か教えて下さい。 問題:モル濃度が 1mol/l の濃塩酸(塩化水素HClの水溶液があり、その密度はしておくと,水溶液の濃度 のうど はし だいに全体的に均一になっていく。水溶液は,いったん均一になると,逆戻りすることはな い。したがって,ふたたび,底の方の濃度が濃くなったりすることはない。 問題(2 学期期末)
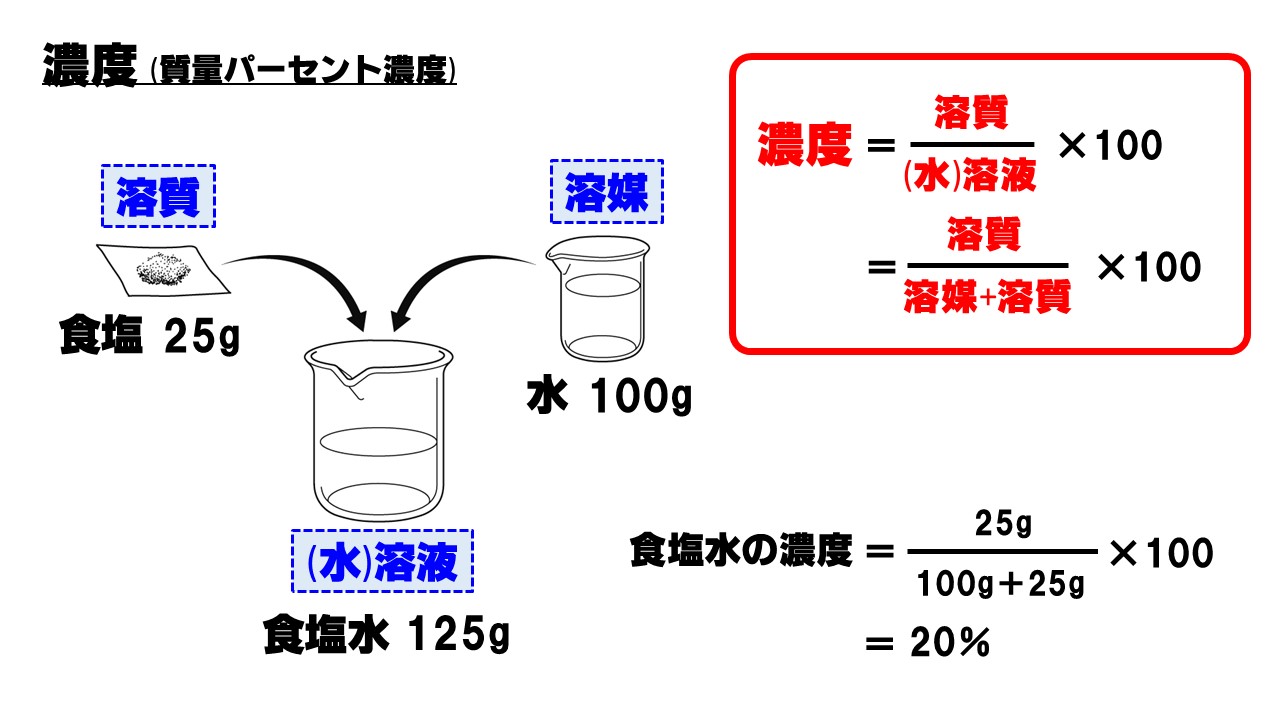
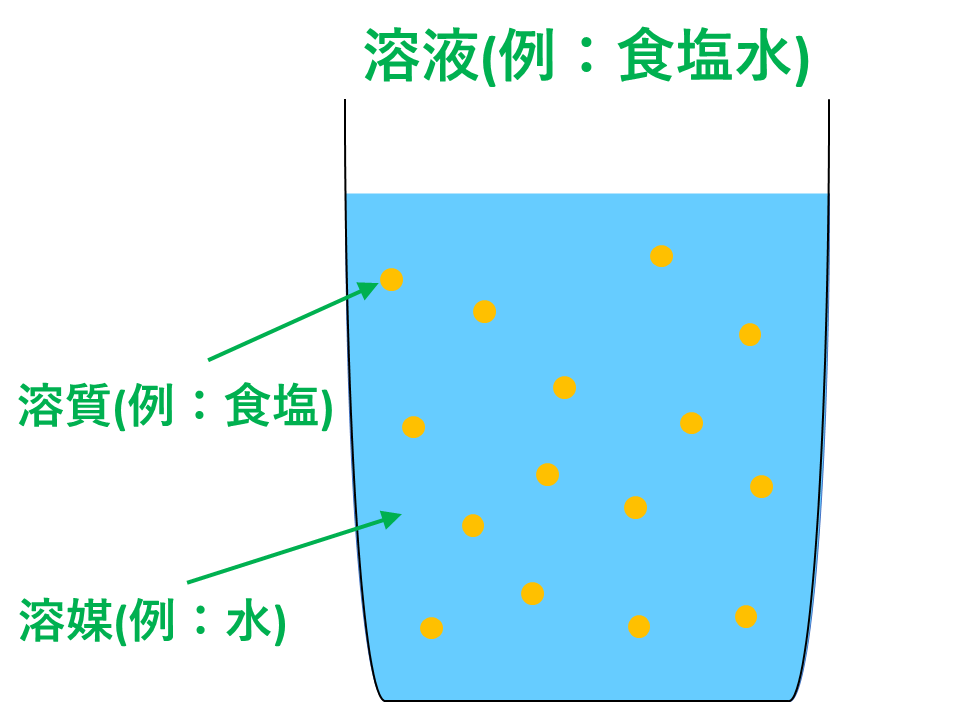
濃度には色々な表し方がありますが、一番わかりやすいものから考えてみましょう。 質量パーセント濃度〔%〕= (溶質の質量〔g〕/溶液の質量〔g〕)×100 図のように、食塩50gと水0gがあります。 この食塩を水に溶かすと、食塩水250gできます。質量パーセント濃度の求め方がわかったところで、練習問題をやってみましょう。 問題1 gの食塩を水に溶かして400gにしました。 この食塩水の質量パーセント濃度を求めましょう。 問題: 食酢中の酢酸の質量パーセント濃度はどれだけか。 食酢100g中に何グラムの酢酸があるか???と読み取れますか???? ・%とは百分率 ・質量濃度とは(溶質)/(溶液) = (溶質)/(溶媒溶質)が質量で表した物 この二つが分かっていると、読み取れるはず
濃度を計算する問題 2組の入口へ 説明へGO 1 水酸化ナトリウムの結晶gを水80gに溶解させ、水酸化ナトリウム水溶液を作る。この水溶液の密度を12g/cm 3 とするとき、以の濃度を求めよ。 (原子量H=10,O=16,Na=23) 1,質量パーセント濃度 2,モル濃度・質量パーセント濃度 レベル分けして求めてみよう! 1850 ・高校入試対策 理科 音の計算問題 難問part1 1351 ・公立高校入試直前 数学 対策テスト ・大学入試 大学受験 数学 解説 良問 03年東京大学 数学解説 数Ⅰ・図形と計量 高校数学 2421濃度溶解度 チェックテスト 質量パーセント濃度を求めよ。(割り切れない場合小数第2位で四捨五入) 500gの水溶液の中に溶質が35g溶けている場合。 7% 300gの水溶液の中に溶質がg溶けている場合。 67% 水60gに溶質gを溶かした場合。 25% 水180gに溶質gを溶かした場合。




5問2 質量パーセント濃度 高校化学計算問題 Youtube




4 6 溶液の濃度 おのれー Note
(2)この砂ತ⽔の質࿂パーセントടಁを求めなさい。 (25/125)×100 ( % ) (3)質࿂パーセントടಁが45%の砂ತ⽔0g 作りたい。何g の⽔に何g の砂ತをཧかせば よいか。 (x/0)×100=45 x=90 ( ⽔110g 砂ತ90g )質量パーセント濃度(%)= 溶質 溶質+溶媒 ×100 よって 80 180 ×100=444・・・・ これを四捨五入する 固体を水にとかし再び結晶として取り出すことを再結晶という。 各物質の60℃と30℃の溶解度をグラフから読み取るとまずは、問題文を読んでいきます。 問題文で何が与えられているか、最終的に何を求めるのかを読み取るのが重要です。 質量パーセント濃度が 22% 、密度が 12g/mL の水酸化ナトリウム水溶液があります。 この水溶液の モル濃度 を求めていきましょう。




中1 理科 中1 質量パーセント濃度 問題 中学生 理科のノート Clear



モル濃度 質量パーセント濃度 質量モル濃度 濃度計算のコツも解説 受験メモ
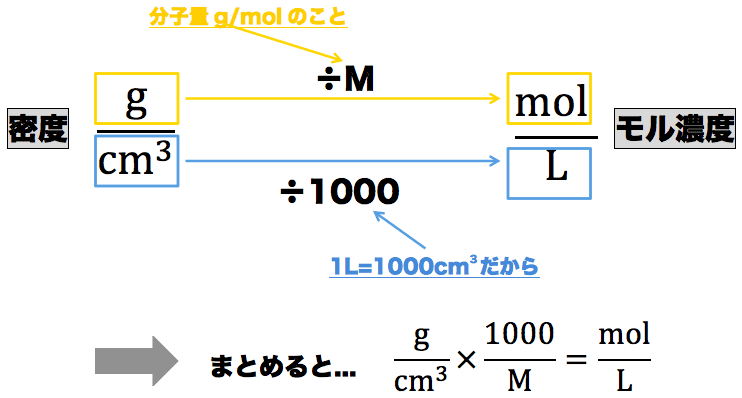
モル濃度とは、溶質のモル (mol)/溶液の体積 (L)で表される、入試必出の知識です。 本記事では、溶液、溶媒、溶質の違い、モル濃度と密度、質量パーセント濃度の違い、公式、求め方、関係性について、図と入試頻出の練習問題でわかりやすく解説します溶液の質量に対する溶質の質量を%で表したものを何というか。 質量パーセント濃度 一定量の水に物質を溶かしていった時に、それ以上溶けることのできない状態を何というか。 飽和 (5)のときの水溶液を何というか。 飽和水溶液 溶解度とは何か。質量パーセント濃度が 98% 、密度が 18g/mL の濃硫酸があります。 この濃硫酸の モル濃度 を求める問題です。 今回も、濃硫酸の体積や質量は書かれていませんね。 体積を 1L=1000mL としておきましょう。 それでは、実際に計算をしていきます。 今回もモル




高校入試理科 質量パーセント濃度攻略法 Youtube




質量パーセント濃度の求め方とモル濃度の違い
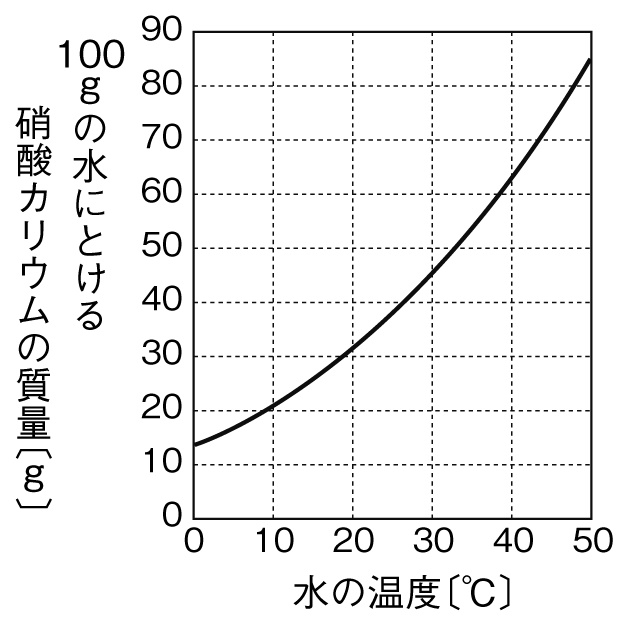
濃度計算 質量パーセント濃度を求めよ。(割り切れない場合は小数第1位を四捨五入して整数で答えよ) 0gの水溶液の中に、溶質が30gが溶けている場合。 水460gに溶質40gを溶かした水溶液。 150gの水溶液のうち、100gが溶媒の場合。 次の問いに答えよ。 問題: 食酢中の酢酸の質量パーセント濃度はどれだけか。 食酢100g中に何グラムの酢酸があるか???と読み取れますか???? ・%とは百分率 ・質量濃度とは(溶質)/(溶液) = (溶質)/(溶媒溶質)が質量で表した物 この二つが分かっていると、読み取れるはず質量パーセント濃度= 溶質 溶媒+溶質 ×100なので 64 164 ×100=390・・・ これを四捨五入する 図から、塩化ナトリウムの溶解度は30℃で36gになっているので、そこまで冷やせば硝酸カリウムのみをできるだけ多く取り出せる。




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




中1 理科 中1 32 質量パーセント濃度 Youtube
まずは、問題文の内容を読み取っていきます。 この問題では、質量パーセント濃度が 8% 、密度が 11g/mL の水酸化ナトリウム水溶液があります。 この水溶液の モル濃度 を求めるのですね。 これまでの問題と同じ形式なので、解くための流れを押さえましょう。 中学1年理科。質量パーセント濃度の計算特訓を行います。 レベル★★★☆ 重要度★★☆☆ ポイント:食塩(溶質)の量に注目問題のダウンロードはこちら!計算プリント「濃度計算特訓」質量パーセント濃度の計算質量パーセント濃度の計算を行う前に質量パーセント濃度 計算問題 次の問いに答えよ。 (1) 砂糖水250gがある。この中に砂糖がg溶けている場合、この砂糖水の質量パーセント濃度は何%か。




高校受験対策 理科9 質量パーセント濃度 Youtube




溶液の質量パーセント濃度の求め方と比重を利用した計算問題
物質の濃度について、練習問題を解いていきましょう。 質量パーセント濃度〔%〕= (溶質の質量〔g〕/溶液の質量〔g〕)×100 (1)は、質量パーセント濃度を求める問題です。 質量パーセント濃度 から モル濃度 を求める場合 問題:質量パーセント濃度が40%の水酸化ナトリウム水溶液(密度140g/cm 3 )のモル濃度は何mol/Lか。 ① 溶液1Lの質量を求める 140 =(2) 1400g ② 溶質の質量を求める (2) 1400 40 /100=(4) 560g 質量パーセント濃度 水溶液の質量に対する溶質の質量の比を水溶液の濃度といい、濃度を百分率(%)で表したものを質量パ-セント濃度といいます。 <求め方> (※水溶液=水+溶質) 溶解度と質量パーセント濃度の練習問題 問題1 まずは、一問一答




高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月



質量パーセント濃度 体積モル濃度 質量モル濃度 添付ファイルご覧くださ Yahoo 知恵袋
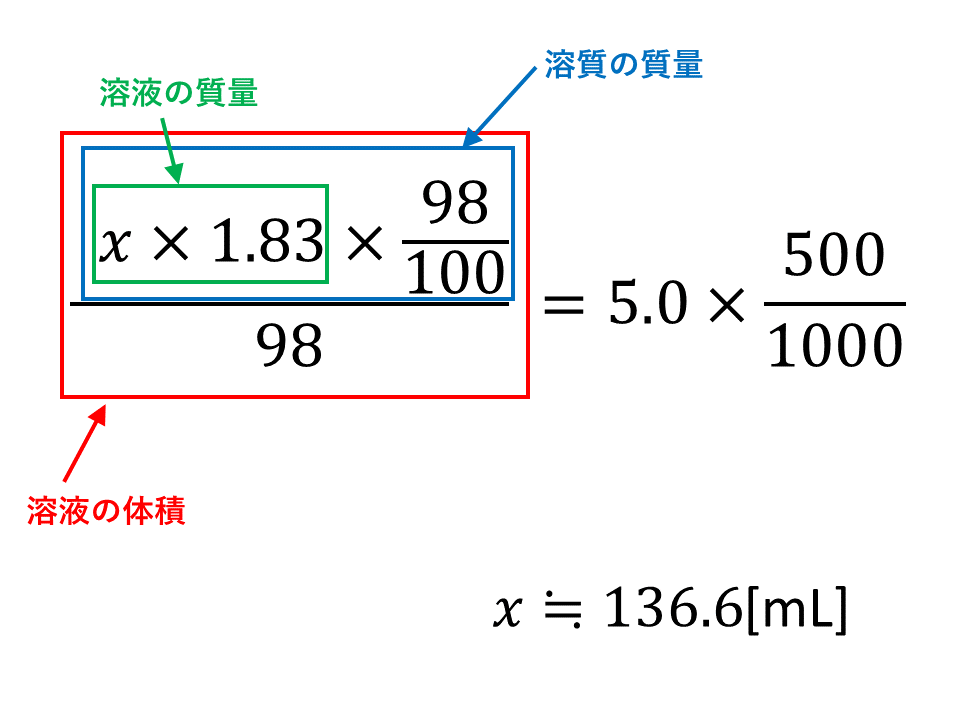
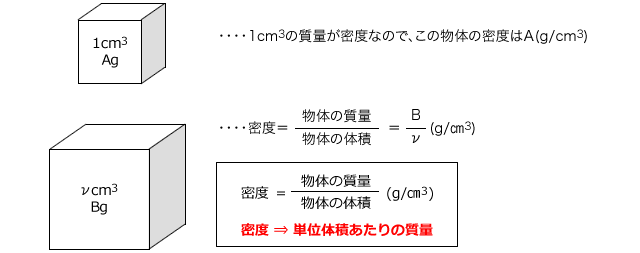
物質の質量(g) 物質の体積(㎤) (1)体積が ㎤で質量が gの物体がある。この物体の密度は 何g/㎤か。 (2)体積が ㎥ で質量が kgの物体がある。この物体の密度は 何g/㎤か。 (3) cmの立方体の形をした物体があり、この物体の質量は (4)密度 g/㎤体積 ㎤の物体がある。 質量パーセント濃度の計算問題集基本編 この回の問題は最初、まず問題だけを読んで自分でチャレンジしてましょう。 そうすればけっこう実力が上がると思います。 13gの塩化水素を使いきり、5%の塩酸を作りたい。 この塩酸を作るためには、何g の 質量パーセントン濃度とモル濃度 多くの高校生が苦手なものとして、濃度の変換がある。 現在、高校化学で登場する濃度は化学基礎と化学で3種類ある。 質量パーセント濃度、 モル濃度、 質量モル濃度。 このうち、質量モル濃度だけは考え方が違うのだが




5分でわかる モル濃度 溶液1l中に溶質が何モル溶けている 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン




溶液の質量パーセント濃度の求め方と比重を利用した計算問題




理科 テストによく出る 濃度の計算方法 家庭教師のやる気アシスト




この問題の一つ目の モル濃度を求める計算の部分で 1 1 11と 1 1000が何を Clear




高校受験対策 理科 質量パーセント濃度 熱量 の問題 動画 19ch




高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく



中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




化学勉強法 センター試験09 Mol濃度から質量パーセント濃度へ 大村の化学勉強法




この問題の解き方を教えていただけませんか Clear




中1 理科 質量パーセント濃度の計算 P塾




中学1年生 理科 水溶液の性質 練習問題プリント 無料ダウンロード 印刷 ちびむすドリル 中学生




質量パーセント濃度の計算問題集 応用編 Menon Network



Q Tbn And9gcq4xadjgniphjogbjmt5uobvopqqffx8mza3t1ztvachjwqfi1c Usqp Cau




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット



急募 高校化学質量パーセント濃度計算記号選択問題 7の Yahoo 知恵袋



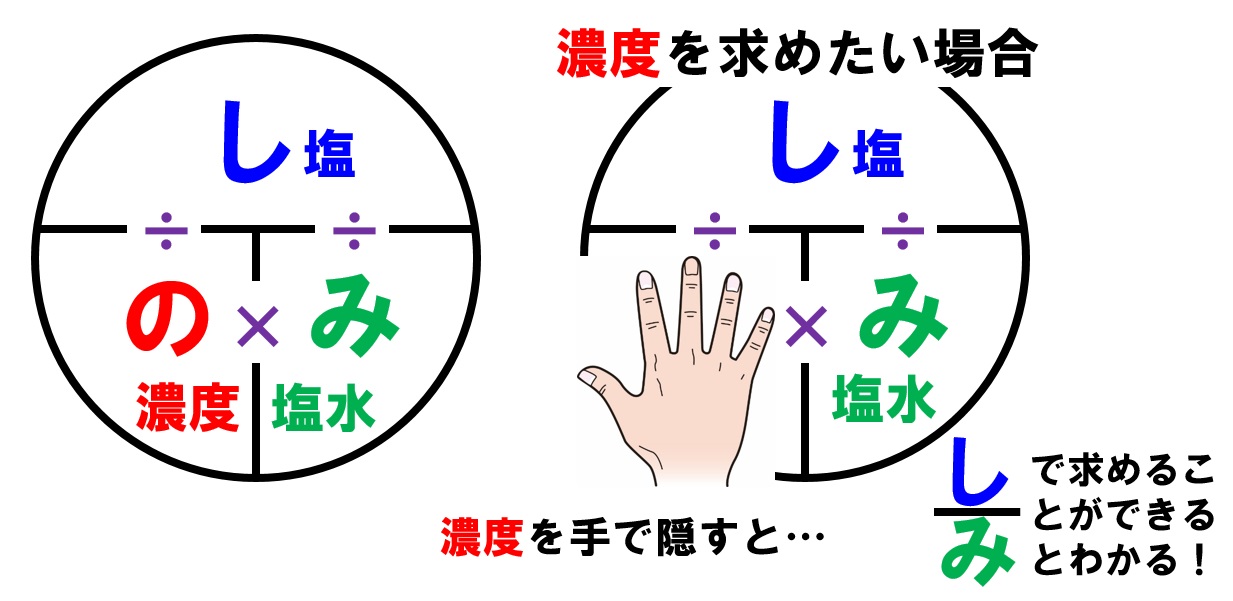
中1理解の 質量パーセント濃度 公式ですが く も わみ Yahoo 知恵袋




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット



中1理科 濃度 質量パーセント濃度 のポイント Examee




至急 質量パーセント濃度が98 の濃硫酸の密度は1 8g Cm3である この 高校 教えて Goo




モル濃度 質量パーセント濃度の単位変換 高校化学 物質量 13 Youtube




高校化学基礎 濃度の計算 練習編 映像授業のtry It トライイット



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




高校化学基礎 濃度の計算 練習編 映像授業のtry It トライイット



濃度の応用




危険物資格取得のための高校化学no 1 濃度計算 F M サイエンスブログ




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




高校化学基礎 硫酸とモル濃度 映像授業のtry It トライイット




1分でわかる質量パーセント濃度の公式や求め方 基本を登録者数95万人人気講師がわかりやすく解説 ページ 4 4 Study Z ドラゴン桜と学ぶwebマガジン




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




溶液の濃度 無料で使える中学学習プリント




溶液の濃度に関する問題 完全攻略チャート 過去問解説集 自宅でできる受験対策ショップ ワカルー Wakaru



モル濃度 質量パーセント濃度 質量モル濃度 濃度計算のコツも解説 受験メモ
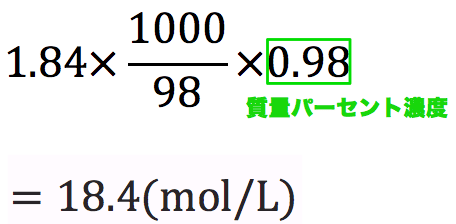



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




中学理科 計算問題 質量パーセント濃度の計算 Youtube




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




理科 中1 27 質量パーセント濃度 Youtube




12月10日更新 第36回 高校入試をみる 2020年度青森県 理科 4 成績 上がってます 根城学習塾 八戸市




濃度のはなし 高校生向け モル濃度と質量モル濃度について 学習内容解説ブログ




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




中学1年の理科 動画 質量パーセント濃度の問題 水溶液 19ch



Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ



これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく



1



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine




高校生物基礎 腎臓のイヌリン濃縮率や原尿量などの計算問題の解き方 高校生物の学び舎




4 6 溶液の濃度 おのれー Note




高校化学 中和滴定などの問題 質量パーセント濃度以外 どれも自分の力 化学 教えて Goo




化学勉強法 センター試験09 Mol濃度から質量パーセント濃度へ 大村の化学勉強法




至急 質量パーセント濃度が98 の濃硫酸の密度は1 8g Cm3である この 高校 教えて Goo



高校1年化学基礎です 5番の問題がさっぱりわかりません モル濃度の公式と質量 Yahoo 知恵袋



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する



Q Tbn And9gct5ugrju6fgyyg3ivuopnykcprqdb915pbi5iylny2zus3hrklx Usqp Cau



溶質を求める



Thinkstock Images




質量パーセント濃度に関する問題です 0 4がどこから出てきたのかわかりません Clear



高校化学の質問です 溶液のモル濃度と質量パーセント濃度を互い Yahoo 知恵袋
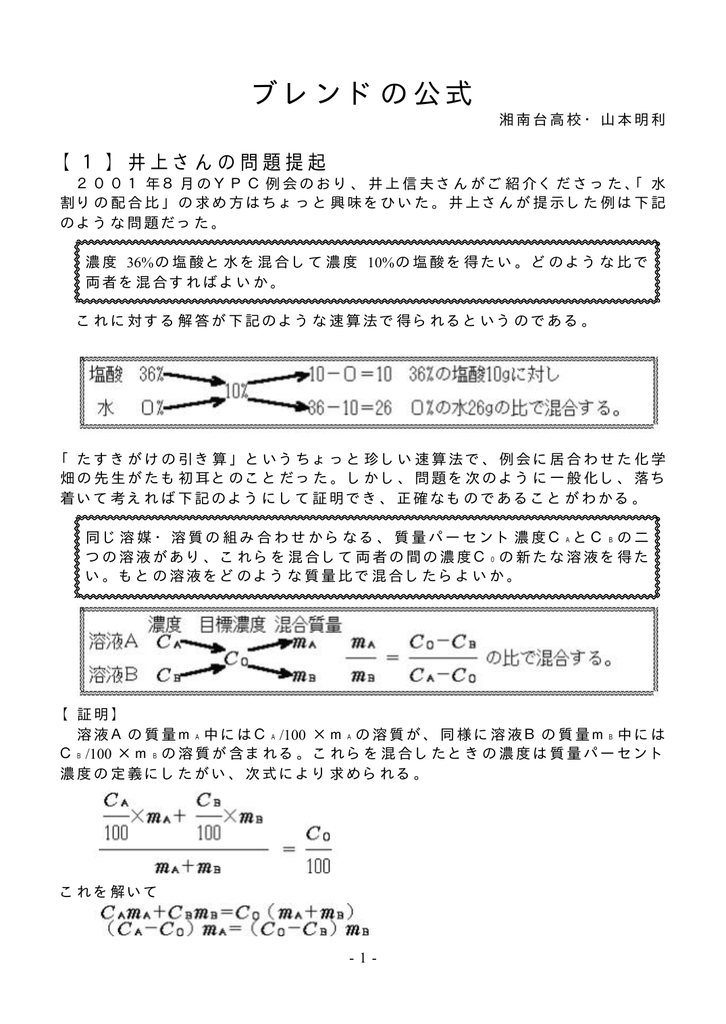



ブレンドの公式 Pdfファイル538kb




都立高校入試理科化学 濃度 対策 坂本良太 Note




16年度 山梨県公立高校入試 理科 問題 4 8




濃度のはなし 中学生向け 質量パーセント濃度について 学習内容解説ブログ




برچسب 質量パーセント濃度 در توییتر



中学理科 水溶液の性質 ママ塾ノート




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム



1
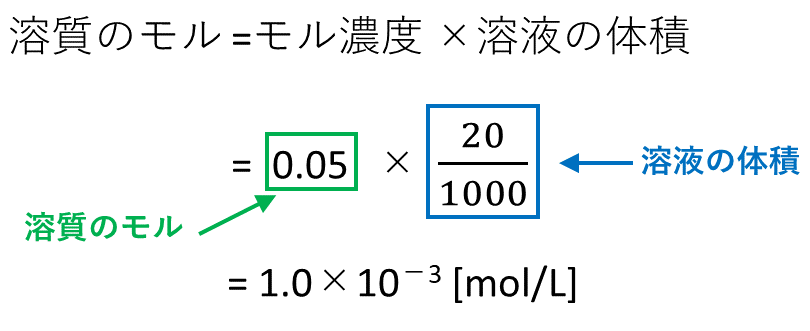



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する




4 6 溶液の濃度 おのれー Note




質量パーセント濃度の計算問題集 応用編 Menon Network




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu
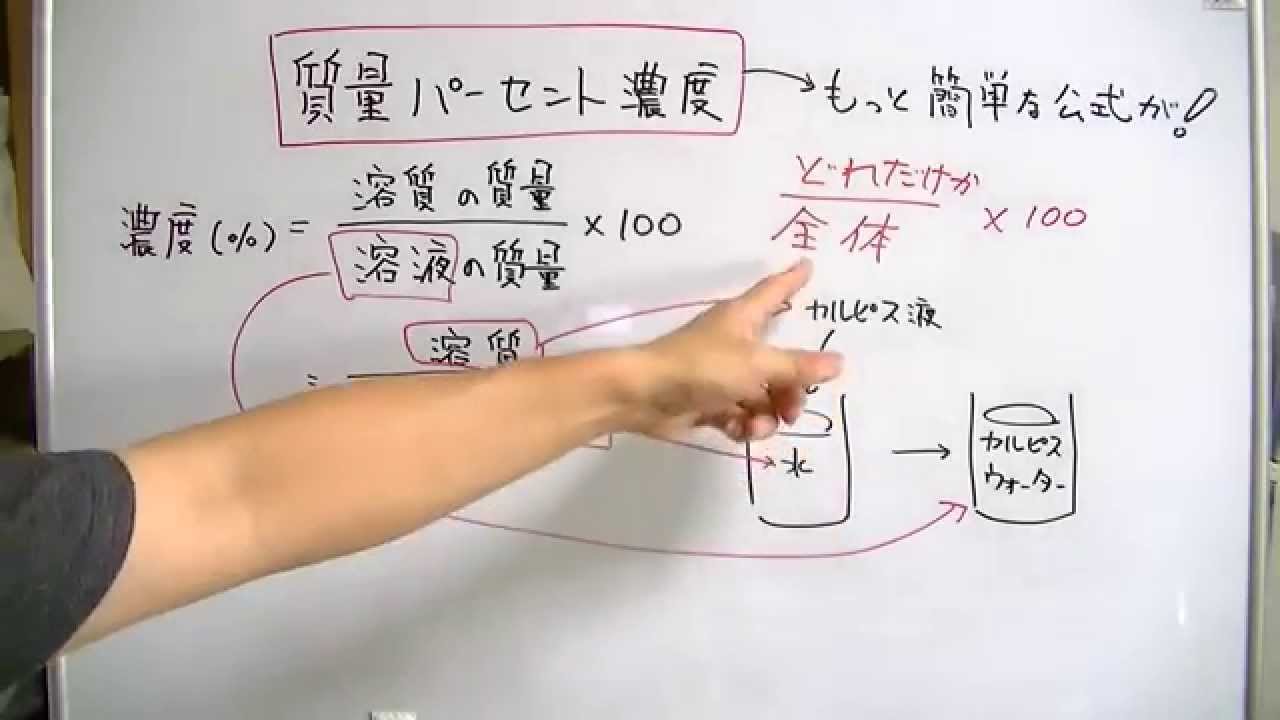



質量パーセント濃度 簡単な公式で覚えよう おときち副塾長 電脳空間学習塾かもん Youtube




برچسب 質量パーセント濃度 در توییتر
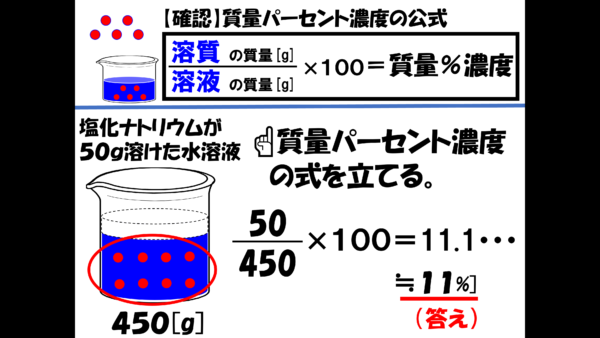



危険物資格取得のための高校化学no 2 濃度計算 F M サイエンスブログ




高校化学基礎 濃度の計算 練習編 映像授業のtry It トライイット
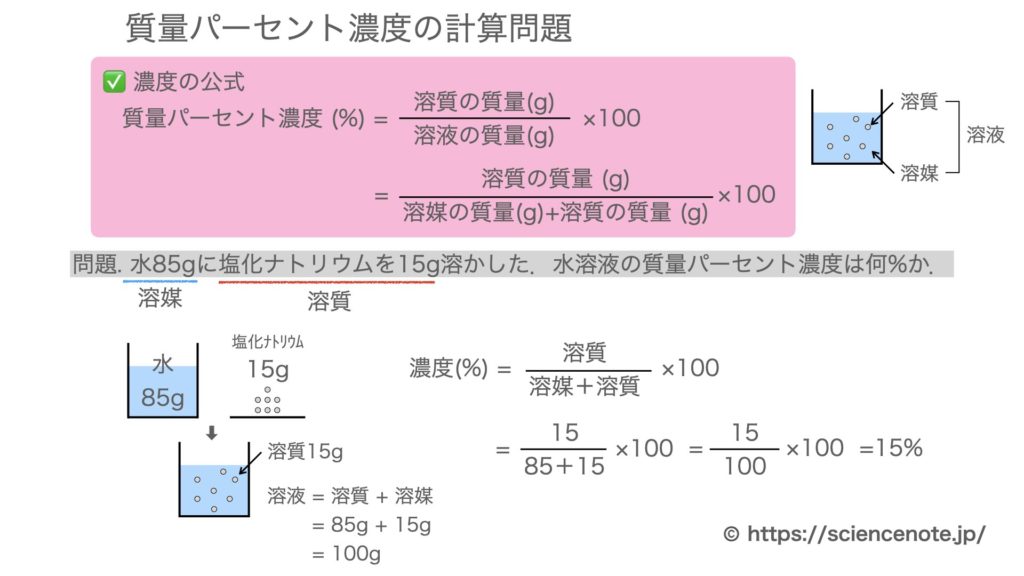



水溶液と質量パーセント濃度の計算問題 Hiromaru Note




質量パーセント濃度 密度で求められるのは質量ですか Clear




モノマナビ研究所




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ
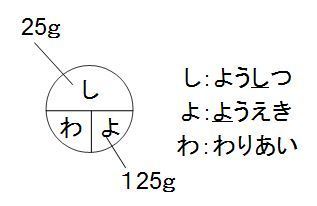



しわよ で覚える質量パーセント濃度 中学テスト 入試対策ノート
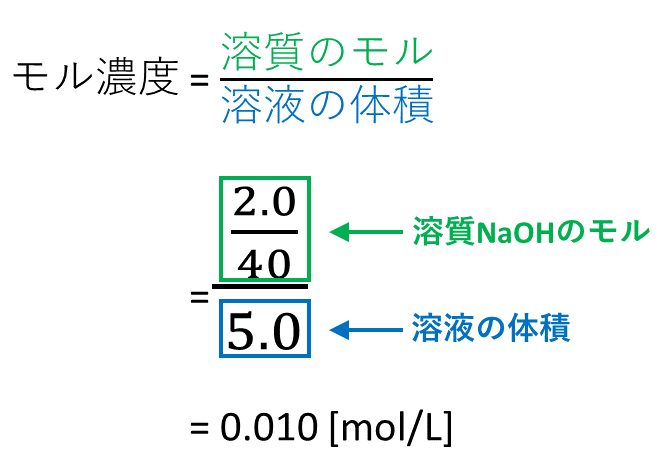



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する




高校化学 質量モル濃度 映像授業のtry It トライイット




この問題の 3 の解き方をわかりやすく教えてください Clear
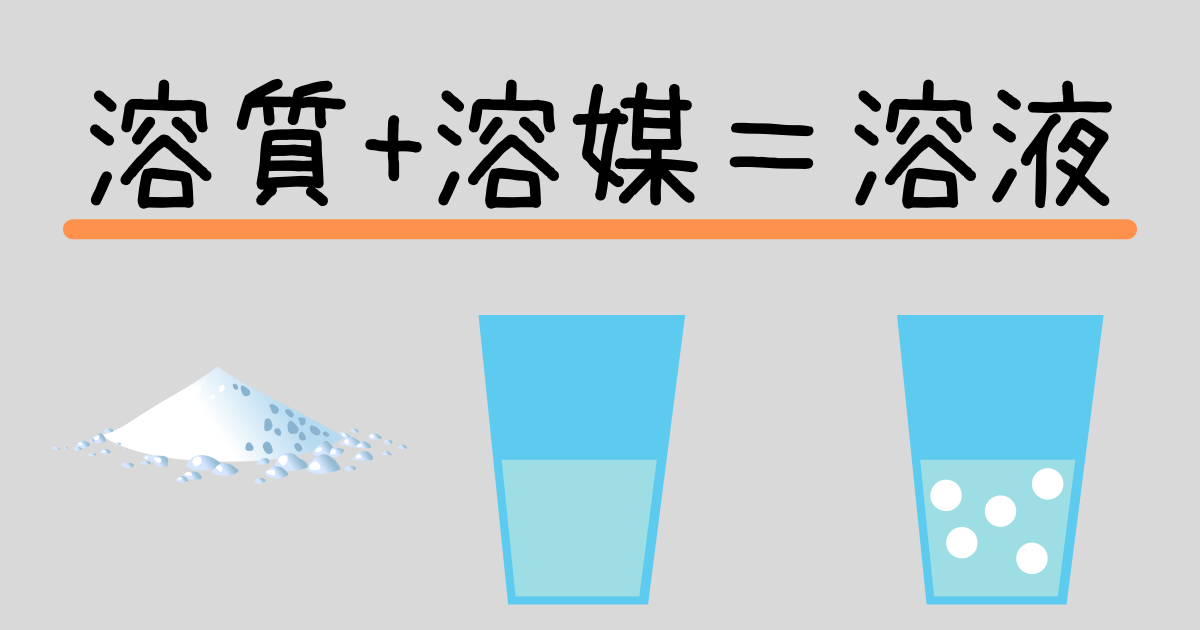



水溶液と質量パーセント濃度の計算問題 Hiromaru Note



高校の化学基礎です 質量パーセント濃度のところなんですが 分からないので画 Yahoo 知恵袋
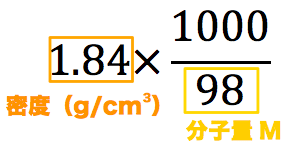



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ



プロ家庭教師集団スペースoneの神奈川県立高等学校過去問研究16年度理科入試問題6 物質の溶け方




4 6 溶液の濃度 おのれー Note




化学基礎 モル濃度と質量パーセント濃度の計算問題 Tekibo



定期テスト対策問題 質量パーセント濃度の計算演習問題 Examee




質量パーセント濃度の計算問題集 応用編 Menon Network




質量パーセント濃度の計算問題集 基本編 Menon Network



0 件のコメント:
コメントを投稿